Des équipes de l’IECB (laboratoires CBMN et ARNA) ont développé des hélices biomimétiques amphiphiles capables de s’organiser spontanément en milieu aqueux pour former des architectures assemblées qui évoquent les structures des protéines. Ces travaux qui viennent d’être publiés dans la revue Nature Chemistry, s’appuient sur des résultats structuraux en diffraction des rayons X, spectrométrie de masse à mobilité ionique, cryo-microscopie électronique et RMN obtenus sur les différents équipements de la plateforme.
Inspirés par les édifices polypeptidiques biologiques, l’équipe de Gilles Guichard (Chimie et Cristallographie, CBMN) associée à celles d’Olivier Lambert (Microscopie, CBMN), de Valérie Gabelica (Spectrométrie de masse, ARNA) et de Cameron Mackereth (RMN, ARNA) a réussi à transposer ces processus de repliement et d’assemblage à des chaines moléculaires artificielles (non peptidiques) pour créer dans un environnement aqueux des objets auto-assemblés à l’échelle nanométrique aux formes inédites (faisceaux à 6 hélices et nanotubules de diamètres variés – voir Figure).
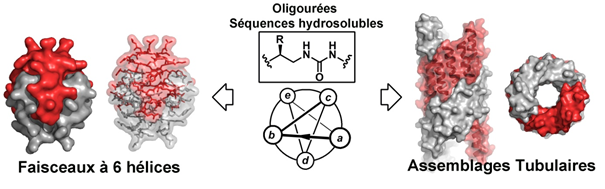
Pour cela, les chercheurs ont conçu des brins oligomériques constitués de chainons urée, porteurs de chaines latérales protéinogènes capables de se replier en structure hélicoïdale. Les séquences des oligomères synthétisés contiennent une certaine proportion de résidus à chaine polaire (hydrophile) et non polaire (hydrophobe) qui vont pouvoir, en fonction de leur arrangement à la surface de l’hélice, conditionner la manière dont les hélices s’assemblent dans l’eau. Comme pour les protéines solubles, l’effet hydrophobe (qui conduit à l’enfouissement des chaines latérales non polaires, les chaines polaires se positionnant quant à elles en surface) est prépondérant. La modularité des séquences d’oligomères dont la synthèse est automatisable suggère que cette approche pourrait servir à la fabrication d’une gamme beaucoup plus étendue d’assemblages, de stœchiométries et de formes nouvelles. Ces travaux pourraient contribuer au développement de nouveaux nanomatériaux fonctionnels, catalyseurs, biocapteurs ou agents de délivrance de principes actifs.
Référence : Gavin W. Collie, Karolina Pulka-Ziach, Caterina M. Lombardo, Juliette Fremaux, Frédéric Rosu, Marion Decossas, Laura Mauran, Olivier Lambert, Valérie Gabelica, Cameron D. Mackereth & Gilles Guichard “Shaping quaternary assemblies of water-soluble non-peptide helical foldamers by sequence manipulation”
Nature Chemistry - parution électronique le 28 Septembre 2015.
